Usefulness of the Cortisol/ACTH-Ratio to diagnose primary hypoadrenocorticism in dogs
Kleintierpraxis 67, 424–433
DOI: 10.2377/0023-2076-67-424
© M. & H. Schaper GmbH. 2022
Publiziert: 08/2022
Zusammenfassung
Bisher gilt als Goldstandard zur Diagnosesicherung eines primären Hypoadrenokortizismus (HA) beim Hund der ACTH-Stimulationstest. Ziel dieser Studie war es, aufzuzeigen, dass zur Diagnose alternativ die Bestimmung des Kortisol/ACTH-Quotienten (Cortisol/ACTH-ratio = CAR) herangezogen werden kann. 120 Hunde mit klinischen Anzeichen eines HA wurden retrospektiv in die Studie aufgenommen, wenn die Konzentrationen von Basalkortisol, endogenem ACTH (eACTH) und den Elektrolyten Natrium und Kalium bekannt waren. Die Gabe eines Steroids innerhalb der letzten sechs Wochen vor Vorstellung führte zum Ausschluss. Bei neun der 120 Hunde lag ein primärer HA vor. Die Berechnung des CAR-Wertes erfolgte mit der Formel: (Kortisol in µg/dl)/(eACTH in pg/ml/10.000). Mittels Receiver Operation Characteristics-(ROC-)Kurve wurde der Cut-off-Wert zur Unterscheidung von Hunden mit oder ohne HA ermittelt, bei welchem die höchste Sensitivität als auch Spezifität vorlag. Der CAR-Wert war bei Hunden mit HA signifikant niedriger als bei Hunden mit gleichen klinischen Anzeichen, aber ohne HA (P < 0,0001). Es gab keine Überlappung zwischen Hunden mit HA und solchen mit HA-ähnlichen Symptomen mit einer Fläche unter der ROC-Kurve von 1,00. Bei einem CAR-Wert > 125 betrugen sowohl die Sensitivität als auch Spezifität 100 %. Aufgrund der erhobenen Daten kann daher zur definitiven Diagnosesicherung eines primären HA die Bestimmung des CAR-Wertes bei Hunden herangezogen werden. Dies ist nicht nur kostengünstiger als ein ACTH-Stimulationstest, sondern es bedarf nur einer einmaligen Blutentnahme und keiner Vorratshaltung von synthetischem ACTH.
Summary
The ACTH stimulation test has so far been considered the gold standard for confirming the diagnosis of primary hypoadrenocorticism (HA) in dogs. The aim of this study was to show that the calculation of the cortisol/ACTH-ratio (CAR) can be used as an alternative. 120 dogs with clinical signs of HA were retrospectively enrolled into the study if the concentrations of basal cortisol, endogenous ACTH (eACTH), and the electrolytes sodium and potassium were known. Exclusion criteria was the administration of a steroid within the last six weeks before presentation. Primary HA was diagnosed in nine of the 120 dogs. The CAR value was calculated using the formula (cortisol in µg/dl)/(eACTH in pg/ml/10.000). Using the Receiver Operation Characteristivs (ROC) curve, the best cut-off value for distinguishing between dogs with and without HA was determined. The CAR value in dogs with HA was significantly lower than in dogs with the same clinical signs but without HA (P < 0.0001). There was no overlap between dogs with HA and those with HA-like clinical signs with an area under the ROC curve of 1.00. With a CAR value > 125, both sensitivity and specificity were 100%. Based on these data, calculation of the CAR value in dogs can be used to conclusively confirm the diagnosis of primary HA. This is not only more cost-effective than an ACTH stimulation test, but also more convenient as it requires only one-time blood sampling and no storage of synthetic ACTH.
Einleitung
Ein Hypoadrenokortizismus (HA) ist eine seltene endokrine Erkrankung bei Hunden, welche durch einen Mangel an Glukokortikoiden und teilweise auch Mineralokortikoiden charakterisiert ist. Aufgrund der Vielzahl an unspezifischen Magen-Darm-Trakt-, Nieren-, neuromuskulären oder Herz-Kreislauf-Symptomen stellt der HA häufig eine diagnostische Herausforderung dar (Scott-Moncrieff 2015). Bei fehlendem Stressleukogramm trotz schwerer Erkrankung, niedriger Natrium- oder Chloridkonzentration, erhöhter Kaliumkonzentration oder einem Natrium/Kalium-Quotienten < 27 sollte eine weiterführende Diagnostik zum Nachweis bzw. Ausschluss einer Nebennierenunterfunktion durchgeführt werden (Kalenyak und Heilmann 2018).
Der Goldstandard zur Diagnosesicherung eines HA ist der ACTH-Stimulationstest (Scott-Moncrieff 2015, Kalenyak und Heilmann 2018). Nach der Blutentnahme zur Bestimmung der Basalkortisolkonzentration wird synthetisches ACTH (Tetracosactid, früher Synacthen®, Novartis Pharma GmbH, Nürnberg, Deutschland, heute Cosacthen®, Dechra Regulatory B. V., Niederlande) injiziert und eine Stunde später die stimulierte Serumkortisolkonzentration gemessen. Liegt der Basal- und Stimulationswert < 2 µg/dl (< 55 nmol/l), gilt der Test als beweisend für das Vorliegen eines HA (Lathan et al. 2008, Scott-Moncrieff 2015, Kalenyak und Heilmann 2018). Da Synacthen® in der Vergangenheit nicht immer lieferbar war und neben einer Testdauer von einer Stunde mit zwei Blutentnahmen selten auch schwerwiegende Nebenwirkungen nach Injektion von exogenem ACTH beschrieben sind (Burkhardt et al. 2011), wurde nach alternativen Ansätzen zur Diagnostik eines HA gesucht. Es ist bekannt, dass eine Basalkortisolkonzentration > 2 µg/dl die Erkrankung mit einem sehr hohen negativen prädiktiven Wert von > 99,8 % ausschließt (Gold et al. 2016). Aufgrund der unzureichenden Spezifität kann jedoch die Basalkortisolkonzentration als alleiniger Parameter nicht zur Diagnose eines HA herangezogen werden (Lennon et al. 2007, Bovens et al. 2014, Gold et al. 2016). Auch eine Ultraschalluntersuchung der Nebennieren kann nur einen Verdacht aussprechen, stellt aber nicht die definitive Diagnose (Wenger et al. 2010). In Studien aus der Humanmedizin konnte mit hoher Sensitivität durch den Kortisol/ACTH-Quotienten eine Nebennierenunterfunktion von normaler Funktion unterschieden werden (Oelkers et al. 1992). Erst kürzlich wurde eine Pilotstudie mit 100 % Sensitivität und Spezifität zur Diagnose eines primären HA beim Menschen publiziert, wenn der Kortisol/ACTH-Quotient (Cortisol/ACTH-ratio = CAR) < 3 liegt, wobei die Kortisolkonzentration in nmol/l und die eACTH-Konzentration in pmol/l gemessen wurde (Lee et al. 2013). Die Studienlage in der Tiermedizin zur Bestimmung des CAR-Wertes zur Diagnose eines primären HA beim Hund stützt sich auf nur wenige Veröffentlichungen. Drei Studien sind bisher bekannt, in welchen die Berechnung des CAR-Wertes zur Diagnosestellung eines primären HA beim Hund untersucht wurde (Javadi et al. 2006, Lathan et al. 2014, Boretti et al. 2015). Mit insgesamt 15/42, 22/82 und 23/132 Hunden sind bislang nur wenige Tiere mit Nebennierenunterfunktion inkludiert und nur in einer Studie wurden Sensitivität, Spezifität und ein Grenzwert (Cut-off-Wert) zur Diagnose des primären HA definiert. Zudem wurden zur Berechnung des CAR-Wertes in allen drei Studien die Kortisolkonzentration in µg/dl und die eACTH-Konzentration in pg/ml verwendet. Hierdurch entstanden sehr niedrige Zahlenwerte (0,00016–0,009), welche im täglichen Gebrauch schwierig zu erfassen sind. Der direkte Vergleich zwischen den Ergebnissen der humanmedizinischen Studie und den Untersuchungen zur diagnostischen Wertigkeit des CAR zur Diagnose eines primären HA beim Hund wird durch die Verwendung unterschiedlicher Einheiten (SI-Einheiten nmol/l für Kortisol und pmol/l für eACTH vs. konventionelle Einheiten µg/dl für Kortisol und pg/dl für eACTH) der Kortisol- und eACTH-Konzentrationen erschwert. Ziel dieser Studie war es, aufzuzeigen, dass die Berechnung des CAR-Wertes in einer Überweisungsklinik in Deutschland eine einfache Alternative zum ACTH-Stimulationstest ist, um Hunde mit primärem HA von solchen mit ähnlichen Symptomen, aber ohne HA, zu unterscheiden. Zudem sollten die Resultate des Quotienten mit gleicher Zehnerpotenz der Einheit berechnet und in Bezug zu ebenfalls so umgerechneten bereits publizierter CAR-Werten gesetzt werden, um eine Datenlage für die Verwendung eines einfach zu interpretierenden CAR zu schaffen.
Material und Methoden
Top Job:
Hunde
Es erfolgte eine retrospektive Auswertung der Daten aller Hunde, die in der Tierklinik Hofheim zwischen Juli 2017 und Juli 2019 nebst mindestens einem der folgenden klinischen Anzeichen Diarrhoe, Vomitus, Lethargie oder Inappetenz zusätzlich eine Basalkortisolkonzentration sowie die Bestimmung der eACTH-Konzentration vorliegen hatten. Zudem mussten die Elektrolytkonzentrationen von Natrium und Kalium bekannt sein. Ausgeschlossen wurden alle Hunde, welchen in den letzten sechs Wochen vor Vorstellung Steroide jeglicher Art und Dosierung verabreicht wurden.
Die Diagnose HA wurde durch einen ACTH-Stimulationstest (Basalkortisol- und Stimulationskonzentration < 2 µg/dl) gesichert. Ein Ausschluss eines HA erfolgte durch einen ACTH-Stimulationstest oder einen basalen Kortisolwert ≥ 2 µg/dl. Hunde, die eine basale Kortisolkonzentration von < 2 µg/dl aufwiesen, wurden als Nicht-HA diagnostiziert, wenn eine klare andere, die klinischen Anzeichen erklärende Diagnose gestellt werden konnte und/oder die Hunde ein Ansprechen auf eine rein symptomatische Therapie wie Futtermittelumstellung oder Gabe von Probiotika zeigten.
Methoden
Der ACTH-Stimulationstest erfolgte mit 5 µg/kg Synacthen® bzw. Cosacthen® intravenös (Lathan et al. 2008). Die Hormonmessungen wurden in einem kommerziellen Labor (Biocontrol, Bioscentia, Ingelheim, Deutschland), welches am Qualitätsringversuch der European Society of Veterinary Endocrinology (EVE-QAS) (www.esve.org/esve/eve-qas/; Zugriff: 14.04.2022) teilnimmt, durchgeführt. Kortisol wurde mittels eines kompetitiven Immunoassays auf Basis von Chemilumineszenz-Technologie mit einem Messbereich zwischen 0,50 und 75 µg/dl gemessen. Für die Berechnung des CAR-Wertes wurde bei einer Kortisolkonzentration unterhalb der Nachweisgrenze (0,5 µg/dl) ein Wert von 0,4 µg/dl verwendet.
Zur Bestimmung von eACTH wurden die Blutproben nach Abnahme sofort zentrifugiert, das EDTA-Plasma umgehend eingefroren und ohne Unterbrechung der Kühlkette ins Labor geschickt. Dort wurde mittels IMMULITE® 2000 (Siemens Healthcare GmbH, Erlangen, Deutschland), ein Festphasen-, sequenzieller Zweischritt-, Chemilumineszenz-, Immunometrischer Assay, die eACTH-Konzentration bestimmt. Die analytische Sensitivität beträgt 5 pg/ml. Zur Berechnung des CAR-Wertes wurde die Einheit für eACTH von pg/ml in µg/dl umgerechnet (1 pg/ml = 10.000 µg/dl).
Statistik
Die statistischen Berechnungen und grafischen Darstellungen erfolgten mit dem Software-Paket GraphPadPrism. Die Daten waren nicht normalverteilt, weshalb für alle Analysen nicht-parametrische Tests verwendet wurden. Die Berechnung des besten Cut-off-Wertes zur Unterscheidung von Hunden mit oder ohne HA erfolgte mittels Receiver Operating Characteristics(ROC)-Kurve.
Ergebnisse
Unter Berücksichtigung der Ein- und Ausschlusskriterien konnten 120 Hunde in die Studie aufgenommen werden, wovon bei neun Hunden ein HA vorlag und 111 Hunde eine andere Erkrankung hatten. Bei sechs von neun Hunden mit HA war der Natrium/Kalium-Quotient ≥ 27, während bei drei Hunden der Quotient < 27 war.
Die Diagnose HA wurde bei allen Hunden durch einen ACTH-Stimulationstest gesichert (Basalkortisol- und Stimulationskonzentration < 2 µg/dl).
Ein Ausschluss eines HA erfolgte entweder durch einen ACTH-Stimulationstest oder einen basalen Kortisolwert ≥ 2 µg/dl bei 69/111 Hunden. Bei den übrigen 42/111 Hunden war der basale Kortisolwert < 2 µg/dl (Median 1,2 µg/dl, Range < 0,5–1,9 µg/dl) und es erfolgte ein Ausschluss eines HA durch das Auffinden einer anderen Diagnose (z. B. Lymphom, Giardiose) (n = 15) bzw. Ansprechen auf symptomatische Therapie wie Diät (Futtermittelhypersensitivität) (n = 12) oder Probiotikagabe (Probiotika-responsive Enteropathie) (n = 15).
Das Alter der Hunde mit HA lag zwischen einem und zwölf Jahren (Median: 5 Jahre). Drei Hunde mit HA waren männlich (zwei von drei kastriert) und sechs weiblich (drei von sechs kastriert) mit drei Mischlingen und sechs Rassehunden. Das Alter der Hunde ohne HA lag zwischen drei Monaten und 14 Jahren (Median: 4,4 Jahre), davon waren 63 männlich (20/63 kastriert) und 48 weiblich (27/48 kastriert). Es handelte sich überwiegend um Rassehunde (n = 86/111), wobei die Rassen Labrador Retriever (n = 7), Golden Retriever (n = 6), Jack Russel Terrier (n = 5) und Pudel (n = 4) ≥ 4x vorkamen. Andere Rassen waren weniger oft vertreten. Zusätzlich waren 25 Mischlinge eingeschlossen.
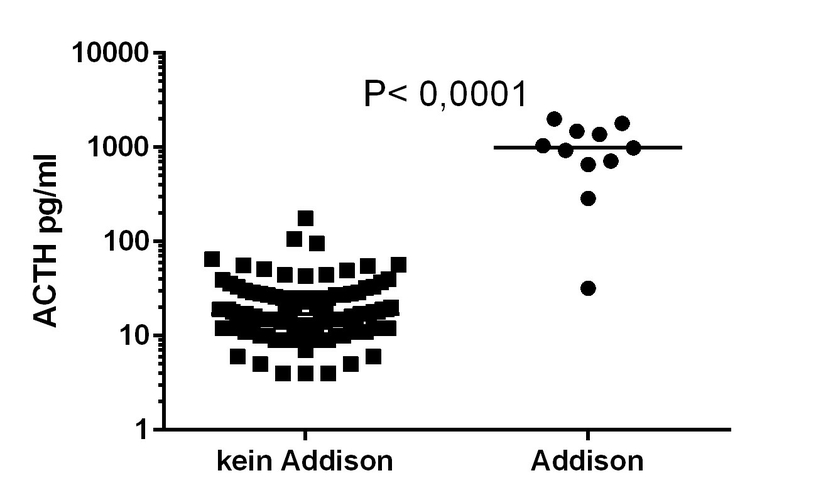
Die Basalkortisolkonzentration der Hunde mit HA lag zwischen 0,4 und 1,6 µg/dl (Median: 0,4 µg/dl); bei Hunden ohne HA war die Basalkortisolkonzentration zwischen 0,4 und 9,8 µg/dl (Median: 1,5 µg/dl) (siehe Abb. 1) und somit signifikant (p < 0,001) höher als bei Hunden mit HA. Bei 70 Hunden ohne HA wurde eine Basalkortisolkonzentration < 2 µg/dl gemessen, bei neun davon sogar unter 1,5 µg/dl. Die eACTH-Konzentrationen war bei den Hunden mit HA zwischen 32 und 1.800 pg/ml (Median: 930 pg/ml) und somit signifikant höher (p < 0,001) als bei Hunden ohne HA mit einer eACTH-Konzentration zwischen 4 und 176 pg/ml (Median: 17 pg/ml) (siehe Abb. 2). Ein Hund mit HA hatte eine eACTH-Konzentration von 32 pg/ml und zusätzlich eine deutliche Lipämie. Es handelte sich um einen 3,5 Jahre alten Collie mit Kolitissymptomatik, der im ACTH-Stimulationstest sowohl basal als auch stimuliert Kortisolwerte unterhalb der Assaygrenze hatte und somit mit HA diagnostiziert wurde, obwohl der Natrium/Kalium-Quotient mit 33 deutlich im Referenzbereich lag.
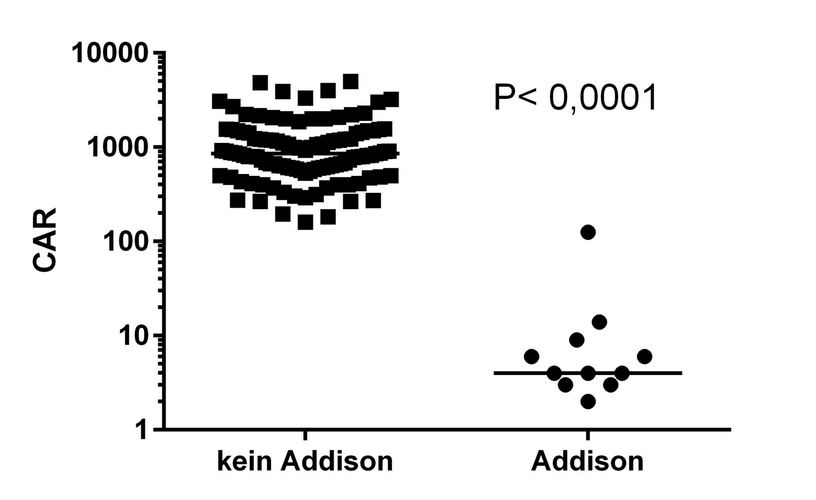
Der CAR-Wert zeigte keine Überlappung zwischen Hunden mit HA mit Ergebnissen zwischen 2,7 und 125 (Median: 5,6) und Hunden ohne HA mit Ergebnissen zwischen 160 und 5.000 (Median: 857,1) (siehe Abb. 3) (p < 0,001). Ein Cut-off-Wert von 125 in der ROC-Kurve lieferte eine Fläche unter der Kurve von 1,00. Der CAR-Wert der 70 Hunde ohne HA mit einer Basalkortisolkonzentration < 2 µg/dl lag zwischen 160 und 3.000 und war signifikant unterschiedlich zu den Hunden, bei denen die Basalkortisolkonzentration ≥ 2 µg/dl betrug (CAR-Wert zwischen 316–5.000) (p < 0,0001). Die Resultate der Elektrolytkonzentrationen sind in der Tabelle 1 zu sehen.
Diskussion
Die Ergebnisse dieser Studie bestätigen, wie bereits in anderen Studien beschrieben, dass der CAR-Wert bei Hunden zur Diagnose eines primärem HA hervorragend geeignet ist (Javadi et al. 2006, Lathan et al. 2014, Boretti et al. 2015). Gesamthaft sind in den vier Studien zur Berechnung des CAR-Wertes 69 Hunde mit primärem HA inkludiert; während in dieser sowie in zwei weiteren Studien eine 100%-Sensitivität und -Spezifität zur Diagnose eines HA vorlagen (Javadi et al. 2006, Lathan et al. 2014), lagen in einer Studie die Sensitivität bei 100 % und die Spezifität bei 99 % (Boretti et al. 2015). Eine Pilotstudie aus der Humanmedizin hatte ebenfalls eine Sensitivität und Spezifität von 100 % zur Diagnose eines primären HA (Lee et al. 2013). Der niedrigste CAR-Wert betrug bei Hunden ohne HA 160. Durch die Transformation von eACTH von pg/ml in µg/dl (dividieren durch 10.000) und somit gleicher Einheit wie Kortisol konnten Werte ähnlich denen beim Menschen berechnet werden (Lee et al. 2013) – in der Studie beim Menschen werden zur Berechnung des CAR-Wertes jedoch SI-Einheiten für Kortisol und eACTH verwendet. Im Gegensatz dazu ist in allen drei zuvor veröffentlichten Studien der CAR-Wert von Hunden in einer Zehnerpotenz von 10–4 angegeben, was die Anwendung für den täglichen Gebrauch schwierig macht.
Ein direkter Vergleich der vier Studien zum CAR-Wert beim Hund ist schwierig, da teilweise in den Studien recht unterschiedliche Resultate erzielt wurden und auch nur in einer Studie ein direkter Cut-off-Wert berechnet wurde (siehe Tab. 2). Der Cut-off-Wert für den CAR in der vorherigen Studie ist mit 100 etwa vergleichbar mit dem hier errechneten optimalen Cut-off-Wert von 125.
Der wahrscheinlichste Grund für die Diskrepanz der Ergebnisse zwischen den Studien sind die unterschiedlichen Assays zur Bestimmung der Konzentration von Kortisol und eACTH. So erfolgte z. B. die Messung von eACTH in dieser Studie mittels Immulite 2000, während in zwei anderen Studien der Assay DCP Immulite 1000 verwendet wurde (Lathan et al. 2014, Boretti et al. 2015). In dieser Studie wurden die Analysen in einem Labor durchgeführt, welches am Ringversuch der European Society of Veterinary Endocrinology teilnimmt (European Veterinary Endocrine Quality Assurance Scheme [EVE-QAS], www.esve.org/esve/eve-qas/; Zugriff: 14.04.2022). Seit der Durchführung dieser retrospektiven Datenauswertung wurde die Kortisolmessung mittels Immulite-2000-Messung aufgrund eines modifizierten Assays angepasst (Dr. Peter Graham, persönliche Kommunikation, 08.12.2020). Somit ist möglich, dass es zu geringgradigen Veränderungen in den Kortisol- und somit auch den CAR-Werten und dem Cut-off-Wert kommt. Es ist also wichtig, Cut-off-Werte des eigenen Labors zu benutzen.
Neben einem primären HA mit Grunderkrankung in der Nebenniere gibt es beim Hund, wenn auch viel seltener, einen sekundären HA mit verminderter ACTH-Sekretion aus der Hypophyse. Eine erniedrigte bis nicht-messbar tiefe ACTH-Sekretion entsteht auch durch die exogene Verabreichung von Steroiden, da dadurch die Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HHN-Achse) durch negatives Feedback beeinflusst wird (Boretti et al. 2015). Schlussendlich kann die ACTH-Konzentration auch durch prä-analytische Fehler falsch erniedrigt sein; so führt z. B. eine Lipämie zur Reduktion der mittels Immulite gemessenen eACTH-Konzentration um 15 % (Vogeser et al. 1999). In dieser Studie wurden zwar Hunde mit zuvor verabreichtem Steroid ausgeschlossen, ob dies aber immer sicher möglich war, kann nicht mit absoluter Sicherheit gesagt werden. Bisher wurde der CAR-Wert nur von einem Hund mit sekundärem HA berechnet (Boretti et al. 2015); er lag bei 6,7. Damit wurde bei dem Hund korrekt ein HA auch mittels CAR-Wert diagnostiziert. Es muss aber damit gerechnet werden, dass Hunde mit sekundärem HA, aber auch nach exogener Steroidgabe, falsch hohe CAR-Werte haben können. Wie lange nach Steroidgabe gewartet werden muss, bis der CAR-Wert korrekt gemessen werden kann, hängt von vielen Parametern ab, wie der Art des verwendeten Steroids (Glukokortikoid, Androgen) (Kempker et al. 2016), Dauer der Gabe, Verabreichungsart (oral, Augentropfen, Hautpräparate etc.) sowie der Dosis. Zusätzlich ist unklar, ob nicht auch das Individuum (Rasse, Alter, Geschlecht, Ernährung etc.) ggf. einen Einfluss darauf hat, wie lange ein exogenes Steroid einen Effekt auf die HHN-Achse hat. Ein Hund dieser Studie hatte eine hochgradige Lipämie und somit könnte der niedrige eACTH-Wert dadurch beeinflusst gewesen sein (Vogeser et al. 1999). Somit ist bei einem Hund mit sehr niedriger Kortisolkonzentration und niedriger eACTH-Konzentration, aber berechtigtem Verdacht auf einen HA, weiterhin ein ACTH-Stimulationstest nötig. Zudem muss natürlich mit absoluter Sicherheit ausgeschlossen werden, dass keine exogenen Steroide verabreicht wurden und prä-analytische Fehler ausgeschlossen sind.
Neben einem Mineralo- und Glukokortikoid-defizienten HA (MGDH), auch als „typischer“ HA bezeichnet, mit typischen Elektrolytverschiebungen und oft einem Natrium/Kalium-Quotienten < 27, gibt es auch einen rein Glukokortikoid-defizienten HA (GDH), oft auch als „atypischer“ HA bezeichnet, mit Elektrolytkonzentrationen sowie dem Natrium/Kalium-Quotienten innerhalb des Referenzbereichs (Natrium-RI 143–153 mmol/l; Kalium-RI 3,9–5,7 mmol/l)(Kalenyak und Heilmann 2018). Es werden unterschiedliche Häufigkeiten des Auftretens eines GDH beschrieben, neuere Untersuchungen haben bei bis zu 30 % der Hunde mit HA einen GDH diagnostiziert (Kalenyak und Heilmann 2018). Eine kürzlich veröffentliche Studie aus Deutschland konnte bei Hunden mit chronischer Magen-Darm-Symptomatik ohne Elektrolytveränderungen bei 4 % ein GDH aufzeigen (Hauck et al. 2020). In dieser Studie wurden sechs von neun Hunden mit einem GDH diagnostiziert, ähnlich wie auch neun von 15 Hunden in einer anderen CAR-Studie einen GDH aufwiesen (Lathan et al. 2014). Die Ursache dieser sehr hohen Prävalenz eines GDH aller Hunde mit HA liegt vor allem daran, dass nur Hunde eingeschlossen wurden, bei denen die eACTH-Konzentration bestimmt wurde. Bei Hunden mit einem Natrium/Kalium-Quotienten < 27 erfolgt dies meist nicht, da schon klar ist, dass es sich nicht um einen sekundären HA, sondern wahrscheinlich um einen MGDH handelt. Es konnte kein signifikanter Unterschied des medianen CAR-Wertes zwischen Hunden mit MGDH von 4 (Range: 3,8–4,3) und Hunden mit GDH von 6 (Range: 2,7–125) gefunden werden, wie auch in der anderen Studie mit hohem Anteil an MGDH kein signifikanter Unterschied auftrat (Lathan et al. 2014).
Eine Basalkortisolkonzentration > 2 µg/dl hat einen sehr hohen negativen prädiktiven Wert zum Ausschluss eines HA (Kalenyak und Heilmann 2018). Aufgrund der unzureichenden Spezifität zwischen 63 und 78 % kann die Basalkortisolkonzentration jedoch nicht zur Diagnose eines HA dienen (Lennon et al. 2007, Bovens et al. 2014, Gold et al. 2016). In dieser Studie hatten alle Hunde mit HA bis auf einen eine Basalkortisolkonzentration unterhalb der Assaygrenze (0,5 µg/dl); bei einem Hund lag der Wert bei 1,6 µg/dl. Somit lag die Sensitivität einer niedrigen Basalkortisolkonzentration bei 100 %. Bei den Hunden ohne HA hatten 70 eine Basalkortisolkonzentration < 2 µg/dl, davon war der Wert bei neun Hunden unterhalb der Assaygrenze (0,5 µg/dl); dies ergibt eine Spezifität von 37 % zum Ausschluss eines HA bei einer Kortisolkonzentration < 2 µg/dl. Diese Spezifität ist niedriger als bei Hunden mit hauptsächlich chronischen Magen-Darm-Beschwerden, bei welchen eine niedrige Basalkortisolkonzentration eine Spezifität von 72 % hatte (Hauck et al. 2020). Eine niedrige basale Serumkortisolkonzentration beim Hund kann beobachtet werden erstens aufgrund der undulierenden Ausschüttung mit teils sehr niedrigen Werten über einen 24-stündigen Verlauf (Kemppainen und Sartin 1984), zweitens bei Vorliegen einer ABCB1-Genmutation (auch bekannt als MDR-1) (Mealey et al. 2007) sowie drittens aufgrund einer Symptomatik, die als kritischer erkrankungsabhängiger HA bekannt ist (Martin 2011). Letztere Ursache wird jedoch kontrovers diskutiert, ob dies bei Hunden überhaupt auftritt (Burkitt Creedon 2014).
Eine Limitation der Studie besteht darin, dass nur bei 43 Hunden ohne HA ein ACTH-Stimulationstest zum Ausschluss der Erkrankung erfolgte. Bei 26 Hunden wurde ein HA ausgeschlossen, da der basale Kortisolwert ≥ 2µg/dl war, bei den übrigen konnte eine finale Diagnose die klinische Problematik erklären, sodass die Wahrscheinlichkeit, einen HA verpasst zu haben, sehr gering ist.
Schlussfolgerung
Zusammenfassend konnte bestätigt werden, dass die Bestimmung des CAR-Wertes zur definitiven Diagnose eines primären HA verwendet werden kann. Da sowohl die Kortisol- als auch eACTH-Konzentration aus einer einzigen Blutprobe gemessen werden können, ist diese Methode logistisch einfacher als ein ACTH-Stimulationstest und erfordert keine Verfügbarkeit von Cosyntropin. Aktuell ist die Bestimmung von eACTH in kommerziellen veterinärmedizinischen Labors in Deutschland im Vergleich zur Messung einer zweiten Kortisolkonzentration teuer, es entfallen jedoch die Verabreichung von Cosyntropin, die zweite Blutprobenentnahme sowie der Preis für Cosyntropin, wodurch die Bestimmung des CAR-Wertes in der Diagnostik eines HA deutlich günstiger ist als ein ACTH-Stimulationstest. Der Nachteil bei der Berechnung des CAR-Wertes ist die Notwendigkeit einer sorgfältigen Probenentnahme und -handhabung. Proben für die eACTH-Messung müssen vor einer Glukokortikoidgabe entnommen werden, da Glukokortikoide die ACTH-Produktion unterdrücken. Außerdem wird eACTH bei Raumtemperatur schnell abgebaut und eine fälschlicherweise erniedrigte eACTH-Konzentration könnte zu einer übersehenen Diagnose eines HA führen. Die Laborempfehlungen bezüglich der Probenhandhabung variieren, aber die meisten Labore empfehlen, die Probe sofort nach der Entnahme einzufrieren und sie während des Versands gefroren aufzubewahren – bei Verwendung eines Kuriers sollte dies aber kein Problem darstellen.
Ethische Anerkennung
Die Autoren versichern, während des Entstehens der vorliegenden Arbeit die allgemeingültigen Regeln guter wissenschaftlicher Praxis befolgt zu haben.
Conflict of interest
Die Autoren versichern, dass keine geschützten, beruflichen oder anderweitigen persönlichen Interessen an einem Produkt oder einer Firma bestehen, welche die in dieser Veröffentlichung genannten Inhalte oder Meinungen beeinflussen können.
Finanzierung
Diese Arbeit wurde nicht unterstützt. Die Autoren versichern, dass sie Daten hierzu auf begründete Nachfrage hin bereitstellen.
Autorenbeitrag
Konzeption oder Design der Arbeit: RN.
Datenerhebung,- analyse und -interpretation: VB, LF, SS, SJ, NB, RN.
Manuskriptentwurf: VB, RN.
Kritische Revision des Artikels: NB, RN.
Endgültige Zustimmung der für die Veröffentlichung vorgesehenen Version: RN, NB.
Korrespondenzadresse
Veronika Bitter
Katharina-Kemmler-Str. 7
65719 Hofheim am Taunus
Literatur
Boretti FS, Meyer F, Burkhardt WA, Riond B, Hofmann-Lehmann R, Reusch CE, Sieber-Ruckstuhl NS (2015): Evaluation of the cortisol-to-ACTH ratio in dogs with hypoadrenocorticism, dogs with diseases mimicking hypoadrenocorticism and in healthy dogs. J Vet Intern Med 29: 1335–1341.
Bovens C, Tennant K, Reeve J, Murphy KF (2014): Basal serum cortisol concentration as a sceening test for hypoadrenocorticism in dogs. J Vet Intern Med 28: 1541–1545.
Burkhardt WA, Guscetti F, Boretti FS, Ivos Todesco A, Aldajarov N, Lutz TA, Reusch CE, Sieber-Ruckstuhl, NS (2011): Adrenocorticotropic hormone, but not trilostane, causes severe adrenal hemorrhage, vacuolization, and apoptosis in rats. Domest Anim Endocrinol 40: 155–164.
Burkitt Creedon JM (2014): Controversies surrounding critical illness-related corticosteroid insufficiency in animals. J Vet Emerg Crit Care 25: 107–112.
European Society of Veterinary Endocrinology. European Veterinary Endocrine Quality Assurance Scheme (EVE-QAS). www.esve.org/esve/eve-qas/ (Zugriff: 14.04.2022).
Gold AJ, Langlois DK, Refsal KR (2016): Evaluation of basal serum or plasma cortisol concentrations for the diagnosis of hypoadrenocorticism in dogs. J Vet Intern Med 30: 1798–1805.
Hauck C, Schmitz SS, Burgener IA, Wehner A, Neiger R, Kohn B, Rieker T, Reese S, Unterer S (2020): Prevalence and characterization of hypoadrenocorticism in dogs with signs of chronic gastrointestinal disease: A multicenter study. J Vet Intern Med 34: 1399–1404.
Javadi S, Galac S, Boer P, Robben JH, Teske E, Kooistra HS (2006): Aldosterone-to-renin and cortisol-to-adrenocorticotropic hormone ratios in healthy dogs and dogs with primary hypoadrenocorticism. J Vet Intern Med 20: 55–56.
Kalenyak K, Heilmann M (2018): Hypoadrenokortizismus beim Hund – ein Update zu Pathogenese, Diagnose und Therapie. Tierarztl Prax Ausg K 46: 163–174.
Kempker K, Güssow A, Neiger R (2016): Transienter, sekundärer Hypoadrenokortizismus nach Behandlung mit Delmadinonacetat (Tardastrex®) bei einem zwei Jahre alten Rüden. Schweiz Arch Tierheilkd 158: 193–197.
Kemppainen RJ, Sartin JL (1984): Evidence for episodic but not circadian activity in plasma concentrations of adrenocorticotrophin, cortisol and thyroxine in dogs. J Endocrinol 103: 219–226.
Lathan P, Moore GE, Zambon S, Scott-Moncrieff JC (2008): Use of a Low-Dose ACTH Stimulation Test for Diagnosis of Hypoadrenocorticism in Dogs. J Vet Intern Med 22: 1070–1073.
Lathan P, Scott-Moncrieff JC, Wills RW (2014): Use of the cortisol-to-ACTH ratio for Diagnosis of primary hypoadrenocorticism in dogs. J Vet Intern Med 28: 1546–1550.
Lee MKV, Vasikaran S, Doery JCG, Wijeratne N, Prentice D (2013): Cortisol: ACTH ratio to test for primary hypoadrenalism: a pilot study. Postgrad Med J 89: 617–620.
Lennon EM, Boyle TE, Hutchins RG, Friedenthal A, Correa MT, Bissett SA, Moses LS, Papich MG, Birkenheuer AJ (2007): Use of basal serum or plasma cortisol concentrations to rule out a diagnosis of hypoadrenocorticism in dogs: 123 cases (2000–2005). J Am Vet Med Assoc 231: 413–416.
Martin LG (2011): Critical illness-related corticosteroid insufficiency in small animals. Vet Clin North Am Small Anim Pract 41: 767–782.
Mealey KL, Gay JM, Martin LG, Waiting DK (2007): Comparison of the hypothalamic pituitary-adrenal axis in MDR1-1Δ and MDR1 wildtype dogs. J Vet Emerg Crit Care 17: 61–66.
Oelkers W, Diederich S, Bahr V (1992): Diagnosis and therapy surveillance in Addison’s disease: Rapid adrenocorticotropin (ACTH) test and measurement of plasma ACTH, renin activity, and aldosterone. J Clin Endocrinol Metab 75: 259–264.
Scott-Moncrieff JCR (2015): Hypoadrenocorticism. In: Feldman EC, Nelson RW, Reusch CE, Scott-Moncrieff JCR (eds.), Canine and Feline Endocrinology. 4th ed. Elsevier/Saunders, St. Louis, Missouri, USA, 494–506.
Vogeser M, Kühnel W, Lambrecht HG, Sitte J, Stracke H (1999): Evaluation of a luminescent enhanced immunoenzymatic assay for plasma corticotropic (ACTH) using the Immulite system. Clin Lab 45: 37–45.
Wenger M, Mueller C, Kook PH, Reusch CE (2010): Ultrasonographic evaluation of adrenal glands in dogs with primary hypoadrenocorticism or mimicking diseases. Vet Rec 167: 207–210.
Kostenfreier Download
Klicken Sie hier, wenn Sie das PDF KTP_08-2022_Bitter.pdf (0.2 MB) herunterladen möchten
Kostenfreier Download
Klicken Sie hier, wenn Sie das PDF KTP_08-2022_Bitter-Tabelle1.pdf (0.03 MB) herunterladen möchten
Kostenfreier Download
Klicken Sie hier, wenn Sie das PDF KTP_08-2022_Bitter-Tabelle2.pdf (0.03 MB) herunterladen möchten