Der Praktische Tierarzt 101, 560–566
DOI: 10.2376/0032-681X-2014
© Schlütersche Verlagsges. 2020
Publiziert: 06/2020
Zusammenfassung
Die equine rezidivierende Uveitis, ERU, ist eine wiederkehrende Augenerkrankung, die durch zunehmende Schädigung des Auges zur Erblindung führt. Sowohl über die Ursache als auch über die Therapie wird weiterhin kontrovers diskutiert. Dies, obwohl in den letzten Jahrzehnten mittels Vitrektomie von lebenden Pferden intraokulare Proben in großer Anzahl unverdünnt gewonnen und untersucht werden konnten.
Einleitung
Seit etwa 2.000 Jahren gibt es Beschreibungen zu einer wiederkehrenden Augenerkrankung (Mondblindheit) beim Pferd (Braun 1995). Obwohl sich in Deutschland die Vitrektomie als sehr erfolgreiche Therapie zur Verhinderung wiederkehrender Schübe etabliert hat und der Nachweis von Leptospiren-Antikörpern bzw. Antigen in intraokularen Proben aus ERU-Augen positiv und aus gesunden Augen negativ verlaufen, gibt es unterschiedliche Ansichten zu Ursache und Therapie. Manche Autoren empfehlen die Vitrektomie unabhängig von positiven oder negativen Leptospirentests, andere bezweifeln deren Nutzen. Zudem wird die ERU teilweise in Deutschland und auch außerhalb des deutschsprachigen Raums als immunmediierte Entzündung angesehen (siehe Abb. 1 und 2).
Intraokulare Leptospireninfektion
1946 fanden Gsell et al. zufällig bei einem Pferd mit ERU einen höheren Leptospiren-Antikörpertiter im Auge als im Serum. Auch andere Autoren beschrieben nachfolgend in den 50er-Jahren des 20. Jahrhunderts solche Fälle (Hartwigk und Stoebbe 1952, Heusser 1952, Schebitz und Dedié 1955). Goldmann und Witmer (1954) stellten Überlegungen zu einer „lokalen Bildung von Antikörpern im entzündeten Gewebe“ an. Sie schlugen vor, spezifische Antikörperkonzentrationen (hier: Leptospiren-Antikörper) in intraokularen Flüssigkeiten und Serum mit Gesamtantikörperkonzentrationen oder Gesamtprotein oder einem anderen Antikörper, der bei der Elektrophorese in der gleichen Serumfraktion wandert, zu vergleichen. Damit sollte beurteilt werden, ob die Antikörper im Auge lokal produziert worden sind oder durch Diffusion in das Auge gelangt waren. So entstand der Goldmann-Witmer-Koeffizient, der später modifiziert wurde und heute noch herangezogen wird, um eine „lokale Antikörperproduktion“ im Auge zu beweisen bzw. einen Beweis für ein lokales Infektionsgeschehen in dem immunprivilegierten Raum des Augeninneren zu erhalten. Nachdem in den 90er-Jahren des vergangenen Jahrhunderts in der LMU München die Vitrektomie (Werry und Gerhards 1991) beim Pferd etabliert wurde, standen Glaskörperproben in großer Anzahl zur Verfügung und es konnten viele Pferde nach Vitrektomie beobachtet werden (Schinagl 2017). Ein Ziel dieser Operation ist, dass der Glaskörper gespült und damit die optische Achse aufgeklart wird. Es zeigte sich jedoch, dass nach der Operation auch Uveitis-Rezidive ausblieben. So wurden die Glaskörperproben auf unterschiedliche Krankheitserreger untersucht und es gelang, neben Antikörpern gegen Leptospiren, lebende Leptospiren im Auge nachzuweisen (Brem et al. 1998). Wollanke et al. (2001) zeigten, dass 90 % der ERU-Augen Leptospiren-Antikörper enthalten und aus intraokularen Proben bei über 50 % Leptospiren angezüchtet werden konnten. In ihrer Habilitationsschrift von 2002 wird mit einem modifizierten Goldmann-Witmer-Koeffizienten oder C-Koeffizient (in der englischsprachigen Literatur GWC oder C-value) gezeigt, dass Leptospiren-Antikörper nicht alleine durch Diffusion durch die geschädigte Blut-Augen-Schranke in den Glaskörper gelangt sein können. Der Gesamteiweißwert in ERU-Augen war im Mittel um das Zehnfache niedriger als im Serum. Ähnliches hatten Goldmann und Witmer (1954) schon beschrieben, als sie die Antikörperkonzentration von Serum und Kammerwasser mit Gesamteiweiß, Gamma-Globulinen und Rotlauf-Antikörpern ins Verhältnis setzten. Der modifizierte GWC errechnet sich wie folgt:
Top Job:
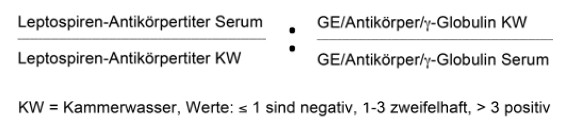
An fiktiven Beispielen soll die Berechnung und Bewertung des GWC erläutert werden, wobei die Gesamteiweißkonzentration im Kammerwasser in Bezug auf Wollanke et al. (2002) zehnfach niedriger angenommen wird als im Serum:
Beispiel 1, Pferd mit ERU
- Leptospiren-Antikörpertiter
Serum 1:200, Kammerwasser 1:100 - Gesamteiweißkonzentration
Serum 60 g/l, Kammerwasser 6 g/l

Beispiel 2, Pferd mit ERU
- Leptospiren-Antikörpertiter
Serum 1:800, Kammerwasser 1:50 - Gesamteiweißkonzentration
Serum 60 g/l, Kammerwasser 6 g/l
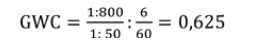
So zeigt sich an Beispiel 1, dass bei der Berechnung des GWC ein im Vergleich zum Serum niedrigerer Kammerwassertiter trotzdem zu einem positiven Ergebnis führen kann, wenn der Referenzstoff (hier: Gesamteiweiß) in deutlich niedrigerem Maße im Auge vorhanden ist. Im Beispiel entspricht der Gesamteiweißwert im Auge nur 1/10 vom Serumwert, während die Antikörperkonzentration im Kammerwasser 1/2 vom Serumwert entspricht. Goldmann und Witmer (1954) gingen in solchen Fällen von einer „lokalen Antikörperproduktion“ im Auge aus. Beispiel 2 zeigt, dass der Unterschied zwischen Serum- und Antikörpertiter hoch sein muss, um bei Anwendung des GWC ein negatives Ergebnis zu bekommen.
Anmerkung: Unter „lokaler Antikörperproduktion“, die Goldmann und Witmer in den 50er-Jahren des vergangenen Jahrhunderts vermutet hatten, ist wahrscheinlich eher ein gerichtetes Einwandern der Antikörper in das Auge während der akuten, durch intraokular vorhandene Leptospiren ausgelösten Entzündung zu verstehen. Da ein antikörperproduzierendes Gewebe im Auge nicht nachgewiesen ist und es sich um eine T-Zell-abhängige Entzündung handelt, ist es wahrscheinlicher, dass die Antikörper während des akuten Entzündungsschubes gerichtet durch die zu diesem Zeitpunkt durchlässige Blut-Augen-Schranke wandern und sich in hoher Konzentration im Auge ansammeln. Um diese Hypothese zu bestätigen, müssten Glaskörper-Serum-Paare zu unterschiedlichen Zeitpunkten vor, während und nach dem akuten Entzündungsschub untersucht werden.
Im weiteren Verlauf wurden viele Hinweise gesammelt, die die Theorie, dass es sich bei der ERU um eine intraokulare Leptospirose handelt, unterstützen: Gesunde Augen liefern fast immer negative Leptospirennachweise (Gesell 2004), erkrankte Augen zeigten positive Nachweise (z. B. Wollanke et al. 2001) und die Vitrektomie verhinderte Rezidive, worüber mittlerweile Langzeituntersuchungen bestehen (Frühauf et al. 1998, Schinagl 2017, Tomördy 2009, Winterberg und Gerhards 1997). Dies ist mit der Entfernung der Leptospiren, also einem Erreger als Ursache der ERU, zu erklären. Eine Autoimmunerkrankung, wie es die Tigerschecken-Uveitis wahrscheinlich ist, kann mit dieser Methode nicht geheilt werden. Die Tigerschecken-Uveitis und seltene Einzelfälle verlaufen sowohl klinisch als auch im Hinblick auf Leptospirennachweise anders: Es besteht in diesen Fällen meist eine chronische hintere Uveitis, die kaum mit äußerlich sichtbaren Symptomen einhergeht und bei denen die Tests auf Leptospiren meist negativ verlaufen (Baumgart und Gerhards 2014).
Eigene Untersuchungen an drei Pferden, die einseitig ERU aufwiesen, ergaben die in Tabelle 1 dargestellten Ergebnisse.
Diese Werte legen ebenso wie die Ergebnisse von Wollanke et al. (2002), bei dem bei 36 Pferden mit ERU der Gesamteiweißgehalt im Serum im Mittel zehnmal höher war als im Glaskörper, den Schluss nahe, dass bei einem Leptospiren-Antikörpertiter im Kammerwasser oder Glaskörper ab 1:100 der GWC positiv ausfällt. Weitere Messungen an einer höheren Anzahl von Pferden wären sinnvoll, um diese Behauptung zu bestätigen.
In der Praxis hat es sich zudem aus Kostengründen und dem auch in ERU-Augen geringen Gesamteiweißgehalt, was eine Bestimmung des GWC erschwert bzw. in der Regel bei einem Titer von 1:100 einen positiven GWC bedeutet, bewährt, Kammerwasserproben ab einem Antikörpertiter von 1:100 als positiv zu bewerten. Loibl (2009) schlägt vor, zuvor auf Leptospiren-IgA zu untersuchen, da diese Untersuchung sensitiver ist.
Immunmediierte Entzündung als Ursache für die ERU
In einem State-of-the-Art-Artikel von Lassaline und Wilkie (2015) zur Pferdeophthalmologie wird eine Veröffentlichung von Gilger (2010) zitiert, in der acht Veröffentlichungen von Deeg et al. (z. B. 2001, 2006a, b, 2007, 2008) erwähnt werden, wenn es um die Ursache der ERU geht. Zusammengefasst sind die Ergebnisse von Deeg et al. auf der Homepage des Instituts für Tierphysiologie der LMU München nachzulesen: „Die equine rezidivierende Uveitis (ERU) ist eine T-Zell mediierte, spontan auftretende Augenerkrankung des Pferdes mit einer Prävalenz von bis zu 10 %, die mittel- bis langfristig zur Erblindung des betroffenen Auges führt. Es konnte gezeigt werden, dass während der Entzündungsphasen die Blut-Retina-Schranke zusammenbricht und autoreaktive CD4+-Zellen diese überwinden. Durch die Identifizierung von mehreren Autoantigenen zählt die ERU inzwischen zu den Autoimmunerkrankungen und stellt aufgrund von pathologischen und immunologischen Parallelen zur humanen autoimmunen Uveitis das einzige spontane Tiermodell für diese Erkrankung dar. Neben dem spontanen Modell gelang die Etablierung eines Tiermodells, bei dem die experimentell ausgelöste Uveitis durch periphere Injektion der Autoantigene Cellular Retinaldehyd-Binding Protein (CRALBP), Interphotoreceptor Binding Protein (IRBP) oder S-Antigen induziert werden konnte.“ So werden Behandlungen zur Unterdrückung des Immunsystems vorgeschlagen, wie zum Beispiel Cyclosporinimplantate (Gilger 2010) oder intravitreale Gentamicininjektionen (Fischer et al. 2019), wobei bei Gentamicin ein immunmodulatorischer Effekt vermutet wird. Brooks schlägt die dauerhafte konservative Therapie mit entzündungshemmenden Mitteln vor (z. B. systemisch Prednisolon, mündliche Aussage IEOC Congress 2008) (siehe Abb. 3 und 4).
Unterschiede in der Auslegung von Leptospirentests
Exemplarisch werden sechs Veröffentlichungen genannt, die die Unterschiede beschreiben: Wollanke et al. (2001) bewerten Proben (aus Europa) ab einem Antikörpertiter von 1:400 positiv und testen mittels MAR (Mikroagglutinationsreaktion), Kultur und PCR. Gesell (2004) bewertet Proben (aus Europa) ab einem Antikörpertiter von 1:100 positiv und testet mittels MAR, ELISA, Kultur und PCR. Faber et al. (2000) bewerten Proben (aus den USA) ab einem Antikörpertiter von 1:100 positiv und testen mittels MAR und PCR. Gilger et al. (2008) bewerten Proben (aus den USA) ab einem GWC von > 1 positiv und testen mittels MAR und PCR. Fischer et al. (2019) bewerten Proben (aus Europa und den USA) ab einem GWC von > 3 positiv und testen mittels MAR und PCR.
Malalana et al. (2017) bewerten Proben (aus Großbritannien) ab einem GWC von > 4 positiv und testen mittels MAR.
Bei diesen Untersuchungen wurden die Tigerschecken-Uveitis (heimtückische „insidious“ Form), die klassische ERU (klassische „classic“ Form) und die hintere ERU (hintere „posterior“ Uveitis) nicht differenziert betrachtet. Dadurch sind die Ergebnisse in Bezug auf Leptospiren verfälscht. Weiterhin sind die klinischen Kriterien, die die klinische Diagnose ERU zulassen, oft nicht genannt bzw. unterschiedlich. Wenn die Unterschiede der verschiedenen Formen der ERU nicht berücksichtigt werden, können Fehler bei der Interpretation der Ergebnisse der Leptospirentests entstehen.
Formen der ERU – eine Einteilungsmöglichkeit
Die Tigerschecken-Uveitis („insidious“ ERU) verläuft in der Regel nicht schmerzhaft und zeigt manchmal vorrangig zunehmende Linsentrübungen bei geringer Glaskörpertrübung oder zunächst starke Glaskörpertrübungen mit folgender starker Linsentrübung. Leptospirennachweise verlaufen in der Regel negativ (siehe Abb. 3 und 4).
Die klassische Form der ERU („classic“ ERU) ist die häufigste und typische Form in Europa und geht mit wiederkehrenden akut auftretenden schmerzhaften Entzündungsschüben, gekennzeichnet durch Hornhauttrübung, Gefäßeinsprossung, Fibrin in der vorderen Augenkammer und Glaskörpertrübung einher. Tests auf Leptospiren-Antikörper verlaufen positiv (siehe Abb. 1 und 2).
Die hintere Uveitis („posterior“ ERU) ist eine seltene Form der ERU, die ohne das Auftreten eines Glaukoms meist erst bemerkt wird, wenn der Glaskörper stark getrübt oder die Netzhaut abgelöst ist oder wenn die Hornhaut wegen erhöhten Augeninnendrucks trüb wird. Meist werden keine intraokularen Leptospiren-Antikörper nachgewiesen.
Weitere diskussionswürdige Punkte bei verschiedenen Untersuchungen zur ERU
In der Untersuchung von Fischer et al. (2019), bei der auch Pferde aus Europa enthalten sind, wird von 50 persistierenden Uveitiden (bei insgesamt 86 untersuchten Augen) gesprochen, sodass wegen dieser auch anteilig hohen Anzahl an persistierenden Uveitiden von einem anderen Verständnis für die Zuordnung auszugehen ist. Gilger (2004) erwähnt, dass in Europa vorwiegend die hintere Uveitis als ERU-Form auftritt (ohne Schmerz, nur Glaskörpertrübung), was keinesfalls bestätigt werden kann.
In einer Untersuchung von Dorrego-Keiter et al. (2016) werden bei ERU-Pferden (aus Europa) weit weniger hohe Prozentzahlen an positiven Leptospiren-Antikörpern und Kulturnachweisen erreicht. Es wird erwähnt, dass laut klinischer Diagnose unabhängig vom Leptospirenergebnis vitrektomiert wird, weil möglichst frühzeitig operiert werden soll. Weiter wurden die Transportmedien etwa 650 km weit in das Untersuchungslabor geschickt. Dabei muss diskutiert werden, was die Kriterien für eine ERU sind und wie lange bei welcher Temperatur die Proben unterwegs waren. Bei eigenen Untersuchungen (Gesell 2004) wurden die Proben warm gehalten und direkt nach der Entnahme in das 21 km entfernte Labor verbracht, wobei die über 50 % positiven Kulturen, wie bei Wollanke et al. (2001) beschrieben, an geringerer Anzahl (n = 14) bestätigt wurden.
Fischer et al. (2019) beschreiben die ERU als immunmediierte wiederkehrende Entzündung. Die Berechnung des GWC (C-value) wird als „ratio between aqueous humor and serum antibody titers“ beschrieben. Diese Angabe zur Berechnung des GWC wird ebenso bei Malalana et al. (2017), die Proben in Großbritannien untersucht haben, und Gilger et al. (2008), die Proben in den USA untersucht haben, gemacht. Auch im Standardwerk von Gilger, Equine Ophthalmology, ist dies so erwähnt: „The C-value is determined by calculating the aqueous serum leptospiral MAT ratio for each serovar” (Gilger und Hollingsworth 2017). In den obigen Beispielen zum GWC ist nachvollziehbar, dass man zu völlig anderen Ergebnissen gelangt, also zu weit mehr negativen Ergebnissen, wenn man nicht die vollständige GWC-Formel anwendet, also nur den Leptospiren-Antikörpertiter in Kammerwasser und Serum für die Berechnung heranzieht, anstatt diesen Quotienten mit einem Referenzstoff ins Verhältnis zu setzen: Das Ergebnis im Beispiel 1 wäre 0,5 statt 5, also deutlich negativ anstatt deutlich positiv. So muss diskutiert werden, ob dies eine Rolle spielen kann, weshalb bei Malalana et al. (2017, Großbritannien), Gilger et al. (2008, USA) und Fischer et al. (2019, USA und Europa) weit weniger positive Proben (im Hinblick auf Leptospiren-Antikörper) festgestellt wurden als von Wollanke et al. (2002, Europa).
Therapien
Hauptsächlich angewandte Therapien sind die dauerhafte konservative Therapie mit unterschiedlichen nichtsteroidalen und steroidalen Antiphlogistika, die intravitreale Gentamicininjektion (low-dose), das subsklerale Einbringen eines Cyclosporinimplantats und die Vitrektomie.
Langzeitergebnisse der unterschiedlichen Therapien
Vitrektomie
Schinagl (2017) kann Langzeitergebnisse von einem Verfolgungszeitraum von sechs Monaten bis 18 Jahren (Durchschnitt zehn Jahre) präsentieren. Von 654 Augen zeigen 96 % kein Rezidiv nach der Vitrektomie, wobei die antiinflammatorische Behandlung nach Vitrektomie zehn Tage beträgt. Dies bestätigt die Untersuchung von Winterberg und Gerhards(1997), die etwa 20 Jahre zuvor an einer kleineren Probeanzahl und kürzeren Kontrollzeiten ähnliche Ergebnisse hatte.
Intravitreale Gentamicininjektion
Bei Fischer et al. (2019) zeigen nach intravitrealer Gentamicininjektion von 59 Pferden 88 % keine Rezidive. Allerdings wird der Beobachtungszeitraum von 30–780 Tagen angegeben und eine antiinflammatorische Behandlung von 30–60 Tagen nach der Injektion. Im Beobachtungszeitraum von 356–780 Tagen sind nur 75 % (9/12) ohne Rezidiv.
Konservative Therapie und Cyclosporinimplantat
Gilger (2010) zeigt auf, dass bei konservativer Therapie 90 % der Augen nach einem Jahr erblindeten. Bei der Therapie mit Cyclosporinimplantat verloren demgegenüber nach durchschnittlich 14 Monaten Verfolgungszeitraum nur 15 % der Augen die Sehfähigkeit. Es ist also von einer Wirksamkeit der Cyclosporinimplantate auszugehen, auch wenn sie nach spätestens vier Jahren erneuert werden sollten und es nur eine Abmilderung der Entzündungsschübe bedeutet.
Fazit für die Praxis
Sowohl die klinischen Kriterien zur Differenzierung unterschiedlicher Formen der ERU als auch die Bestimmung und Auslegung von Laborergebnissen bei der Untersuchung auf intraokulare Leptospirose scheinen in den verschiedenen Untersuchungen zur ERU sehr unterschiedlich gehandhabt zu werden. Dies könnte der Grund dafür sein, dass die Ansichten zu Ursache und Therapie der ERU stark differieren.
Bei Leptospiren-negativen intraokularen Proben bzw. bei der heimtückischen Form der ERU (Tigerschecken-Uveitis) und hinteren Uveitis liegt wahrscheinlich eine autoimmun bedingte Entzündung vor, die mittels Cyclosporinimplantat oder konservativer entzündungshemmender Therapie abgemildert werden kann. Das Einsetzen eines Cyclosprinimplantats in den suprachorioidalen Raum zeigt gegenüber der konservativen Therapie deutliche Vorteile.
Bei Leptospiren-positiven intraokularen Proben bzw. bei der klassischen Form der ERU ist die Vitrektomie das Mittel der Wahl. Hierbei werden die ursächlichen Leptospiren entfernt und damit weitere Entzündungen verhindert.
Die intravitreale low-dose Gentamicininjektion scheint bei der klassischen Form einen positiven Effekt zu haben, aber ein deutlich höheres Rezidivrisiko im Vergleich zur Vitrektomie. Bei der Tigerschecken-Uveitis ist die Wirkung geringer als die von Cyclosporinimplantaten.
Conflict of Interest
Der Autor versichert, dass keine geschützten, finanziellen, beruflichen oder anderweitigen Interessen an einem Produkt oder einer Firma bestehen, welche die in dieser Veröffentlichung genannten Inhalte oder Meinungen beeinflussen können.
Ethische Anerkennung
Der Autor versichert, während der Entstehung der vorliegenden Arbeit die allgemeinen Regeln Guter Wissenschaftlicher Praxis befolgt zu haben.
Funding
Die Arbeit wurde nicht finanziell unterstützt.
Über den Autor: Stefan Gesell-May
FTA für Pferde, FTA Pferdechirurgie, Zusatzbezeichnung Augenheilkunde (Pferde). Studium der Tiermedizin in München. 2001–2010 wissenschaftlicher Mitarbeiter/akademischer Rat auf Zeit in der Klinik für Pferde der LMU München. 2011 Assistenzarzt in der Tierklinik Gessertshausen. 2011–2012 Oberarzt in der Pferdeklinik Aschheim. Seit 2013 selbstständige Tätigkeit in der konsiliarischen Tierarztpraxis für Pferde. Zurzeit tätig im Zentrum für Pferdeaugenheilkunde der Pferdeklinik in Parsdorf.
Korrespondenzadresse
Dr. Stefan Gesell-May, Zentrum für Pferdeaugenheilkunde der Pferdeklinik in Parsdorf, Vaterstettener Weg 6, 85599 Parsdorf, stefan.gesell@pferdeaugenheilkunde.de
Literatur
Baumgart A, Gerhards H (2014): Besonderheiten der Tigerschecken-Uveitis und möglicher Cyclosporin-A-Einsatz in deren Therapie in Deutschland. Pferdeheilkd 30(6): 626–632.
Braun D (1995): Die Geschichte der Erforschung und Behandlung der „periodischen Augenentzündung“ des Pferdes im deutschsprachigen Raum von 1750-1950. Pferdeheilkd 11: 43–49.
Brem S, Wollanke B, Gerhards H, Meyer P(1998): Intraokularer Leptospirennachweis bei 4 Pferden mit rezidivierender Uveitis (ERU). Berl Münch Tierärztl Wochenschr 111: 415−417.
Deeg CA, Kaspers B, Gerhards H, Thurau SR, Wollanke B, Wildner G (2001): Immune responses to retinal autoantigens and peptides in equine recurrent uveitis. Invest. Ophthalmol Vis Sci 42: 393−398.
Deeg CA, Amann B, Raith AJ, Kaspers B (2006a): Inter- and intramolecular epitope spreading in equine recurrent uveitis. Invest Ophthalmol Vis Sci 47: 652−656.
Deeg CA, Pompetzki D, Raith AJ, Hauck SM, Amann B, Suppmann S, Goebel TWF, Olazabal B, Gerhards H, Reese S, Stangassinger M, Kaspers B, Ueffing M (2006b): Identification and functional validation of novel autoantigens in equine uveitis. Mol Cell Proteomics 5: 1462−1470.
Deeg CA, Hauck SM, Amann B, Kremmer E, Stangassinger M, Ueffing M (2007): Major retinal autoantigens remain stably expressed during all stages of spontaneous uveitis. Mol Immunol 44: 3291−3296.
Deeg CA, Hauck SM, Amann B, Pompetzki D, Altmann F, Raith A, Schmalzl T, Stangassinger M, Ueffing M (2008): Equine recurrent uveitis – a spontaneous
horse model of uveitis. Ophthalmic Res 40: 151–153.
Doreggo-Keiter E, Tóth J, Dikker L, Schusser GF (2016): Kultureller Nachweis von Leptospiren in Glaskörperflüssigkeit und Antikörpernachweis gegen Leptospiren in Glaskörperflüssigkeit und Serum von 225 Pferden mit equiner rezidivierender Uveitis (ERU). Berl Münch Tierärztl Wochenschr 129: 209–215.
Faber NA, Crawford M, LeFebvre RB, Buyukmihci NC, Madigan JE, Willits NH (2000): Detection of Leptospira spp. in the aqueous humor of horses with naturally acquired recurrent uveitis. J Clin Microbiol 38(7): 2731−2733.
Fischer BM, McMullen RJ Jr, Reese S, Brehm W (2019): Intravitreal injection of low-dose gentamicin for the treatment of recurrent or persistent uveitis in horses: Preliminary results. BMC Vet Res 15: 29.
Frühauf B, Ohnesorge B, Deegen E, Boevé M (1998): Surgical management of equine recurrent uveitis with single port pars plana vitrectomy. Vet Ophthalmol 1(2-3): 137–151.
Gesell S (2004): Gibt es eine asymptomatische intraokulare Leptospireninfektion beim Pferd? Tierärztliche Fakultät, Ludwig-Maximilians-Universität München, Diss.
Gilger BC (2010): Long-term outcome after implantation of a suprachoroidal cyclosporine drug delivery device in horses with recurrent uveitis. Vet Ophthalmol. 13: 294–300.
Gilger BC, Hollingsworth R (2017): Diseases oft the uvea, uveitis, and recurrent uveitis. In: Gilger BC (ed.), Equine Ophthalmology. 3nd ed. Wiley Blackwell,
Ames, Iowa, 393.
Gilger BC, Michau TM (2004): Equine recurrent uveitis: new methods of management. Vet Clin Equine 20: 417–427.
Gilger BC, Salmon JH, Yi NY, Barden CA, Chandler HL, Wendt JA, Colitz CM (2008): Role of bacteria in the pathogenesis of recurrent uveitis in horses from the southeastern United States. Am J Vet Res 69: 1329−1335.
Goldmann, H, Witmer R (1954): Antikörper im Kammerwasser. Ophthalmologica 127: 323–330.
Hartwikg H, Stoebbe E (1952): Kultureller Nachweis von Leptospiren bei Hund und Pferd. Berl Münch Tierärztl Wochenschr 65: 188–190, 212–214.
Heusser H (1952): Zur Ätiologie der periodischen Augenentzündung. Schweiz Arch Tierheilkd 94: 296−306.
Institut für Tierphysiologie der LMU München, Homepage, Stand 11.01.2020, https://www.phys.vetmed.uni-muenchen.de/forschung/ag_deeg/eru/index.html.
Lassaline M, Wilkie DA (2015): Clinical equine ophthalmology: The current state of the art. Equine Vet J 47: 251–253.
Loibl JK (2009): Immunologische und mikrobiologische Untersuchungen zur intraokular persistierenden Leptospireninfektion bei Pferden mit rezidivierender Uveitis. Tierärztliche Fakultät, Ludwig-Maximilians-Universität München, Diss.
Malalana F, Blundell RJ, Pinchbeck GL, Mcgowan CM (2017): The role of Leptospira spp. in horses affected with recurrent uveitis in the UK. Equine Vet J 49: 706–709.
Schebitz H, Dedié K (1955): Zur Bewertung von Leptospirentitern im Pferdeserum. Zentralbl Veterinärmed 2: 522−543.
Schinagl C (2017): Pars-Plana-Vitrektomie bei Equiner Rezidivierender Uveitis – Langzeitergebnisse zu Rezidivfreiheit, Sehfähigkeit und Bulbuserhalt bei 654 Augen von 549 Pferden. Tierärztliche Fakultät, Ludwig-Maximilians-Universität München, Diss.
Tömördy E (2009): Verlaufsstudie nach Vitrektomie bei equiner rezidivierender Uveitis. Universität Zürich, Diss.
Werry H, Gerhards H (1991): Möglichkeiten und Indikationen zur chirurgischen Behandlung der equinen rezidivierenden Uveitis (ERU). Pferdeheilkd 7: 321−331.
Winterberg A, Gerhards H (1997): Langzeitergebnisse der Pars-plana-Vitrektomie bei equiner rezidivierender Uveitis. Pferdeheilkd 13(4): 377−383.
Wollanke B, Rohrbach BW, Gerhards H (2001): Serum and vitreous humor antibodies to Leptospira interrogans from horses with recurrent uveitis. J Am Vet Med Assoc 219: 795–800.
Wollanke B et al. (2002): Die equine rezidivierende Uveitis als intraokulare Leptospirose. Ludwig-Maximilians-Universität München, Habilitation.
Kostenfreier Download
Klicken Sie hier, wenn Sie das PDF DPT-2020-06-Gesell-May.pdf (0.26 MB) herunterladen möchten
Kostenfreier Download
Klicken Sie hier, wenn Sie das PDF DPT-2020-06-Gesell-May-Tabelle1.pdf (0.03 MB) herunterladen möchten



